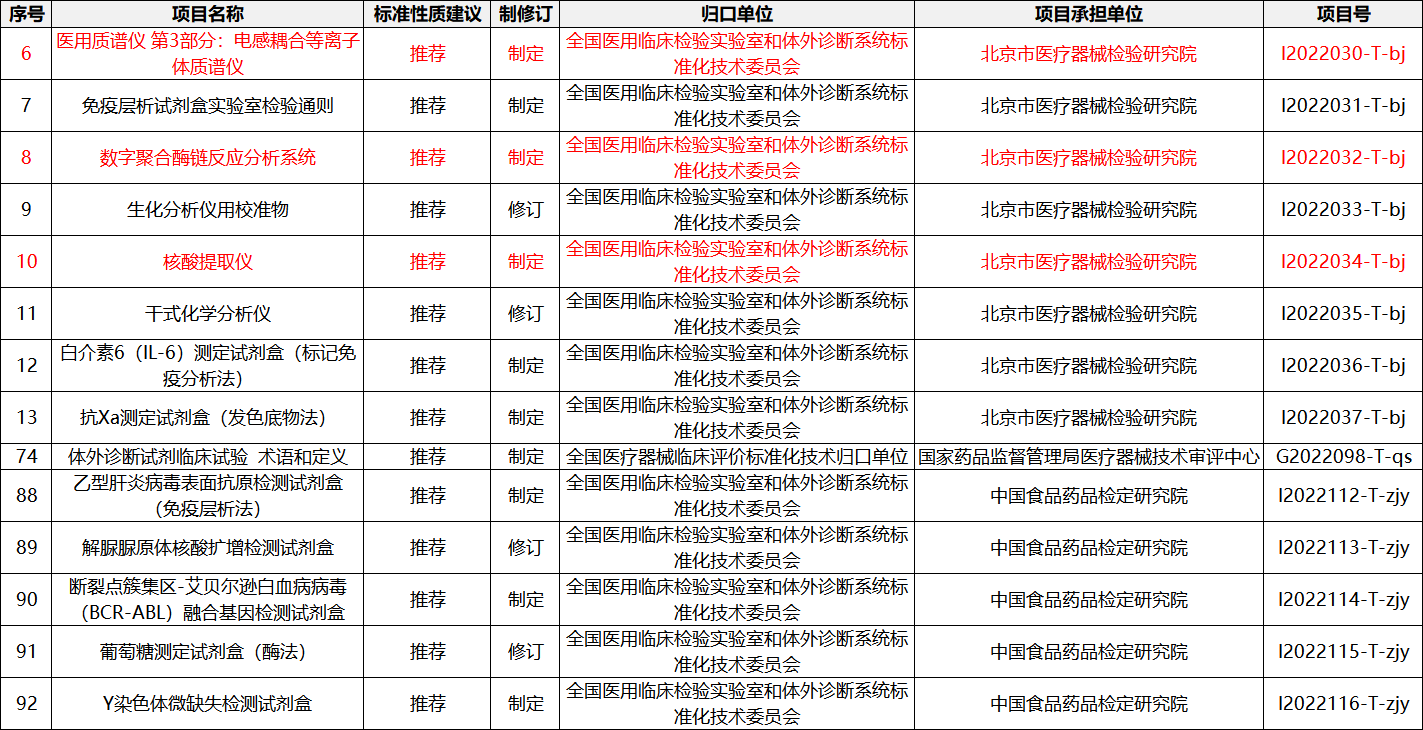
4月28日,國家藥監局印發《2022年醫療器械行業標準制修訂計劃項目的通知》,提出2022年推薦制定醫用質譜儀 第3部分:電感耦合等離子體質譜儀、
數字聚合酶鏈反應分析系統、免疫層析試劑盒實驗室檢驗通則、核酸提取儀、
白介素6(IL-6)測定試劑盒(標記免疫分析法)、抗Xa測定試劑盒(發色底物法)、體外診斷試劑臨床試驗術語和定義、乙型肝炎病毒表面抗原檢測試劑盒(免疫層析法)、斷裂點簇集區-艾貝爾遜白血病病毒(BCR-ABL)融合基因檢測試劑盒、Y染色體微缺失檢測試劑盒等體外診斷相關行業標準。
對生化分析儀用校準物、干式化學分析儀、解脲脲原體核酸擴增檢測試劑盒、葡萄糖測定試劑盒(酶法)等已有行業標準進行修訂。
北京、天津、遼寧、上海、江蘇、浙江、山東、湖北、廣東省(市)藥品監督管理局,中檢院(器械標管中心),器審中心,北京大學口腔醫學院口腔醫療器械檢測中心:
為貫徹國務院辦公廳《關于全面加強藥品監管能力建設的實施意見》,落實《“十四五”國家藥品安全及促進高質量發展規劃》有關要求,按照國家藥監局醫療器械行業標準制修訂工作部署,現將2022年醫療器械行業標準制修訂計劃項目印發給你們,有關要求通知如下:
一、各相關省(市)局要高度重視,認真組織本行政區域標準承擔單位開展標準制修訂工作,加強監督管理,確保按要求完成各項工作任務。
二、國家藥監局器械標管中心要認真組織協調各醫療器械標準化(分)技術委員會及技術歸口單位,嚴格按照《醫療器械標準制修訂工作管理規范》開展標準制修訂工作,加強業務管理和檢查指導,保證標準質量和水平。
三、承擔標準制修訂任務的醫療器械標準化(分)技術委員會及技術歸口單位要做好標準的組織起草、驗證、征求意見和技術審查等工作,要廣泛調研、深入研究,積極借鑒國際標準,確保標準技術內容的科學性、合理性、適用性以及與相關政策要求的符合性。