受理號:CQZ2101436
醫療器械產品注冊技術審評報告
? ? ? ?產品中文名稱:吻合口加固修補片
國家藥品監督管理局
醫療器械技術審評中心
基本信息
一、申請人名稱
北京博輝瑞進生物科技有限公司
二、申請人住所
北京市大興區中關村科技園區大興生物醫藥產業基地藥谷一號國際研發孵化園6#廠房西側
北京市大興區中關村科技園區大興生物醫藥產業基地藥谷一號國際研發孵化園6#廠房西側;
北京市大興區中關村科技園區大興生物醫藥產業基地天富街9號10幢4層北側
技術審評概述
吻合口加固修補片共包含管狀型、平片型、圓型。管狀型和圓型由修補片、背襯、牽引線三部分構成,平片型只有修補片。修補片由脫細胞豬小腸粘膜下層材料制備而成,與背襯用牽引線進行縫合固定。平片型無背襯和牽引線。產品經環氧乙烷滅菌,一次性使用。產品貨架有效期24個月。
本產品配合吻合器用于吻合部位的加固。適用于遠端胃切除術、近端胃切除術、袖狀胃切除術、胃腸吻合術。
表1型號規格表
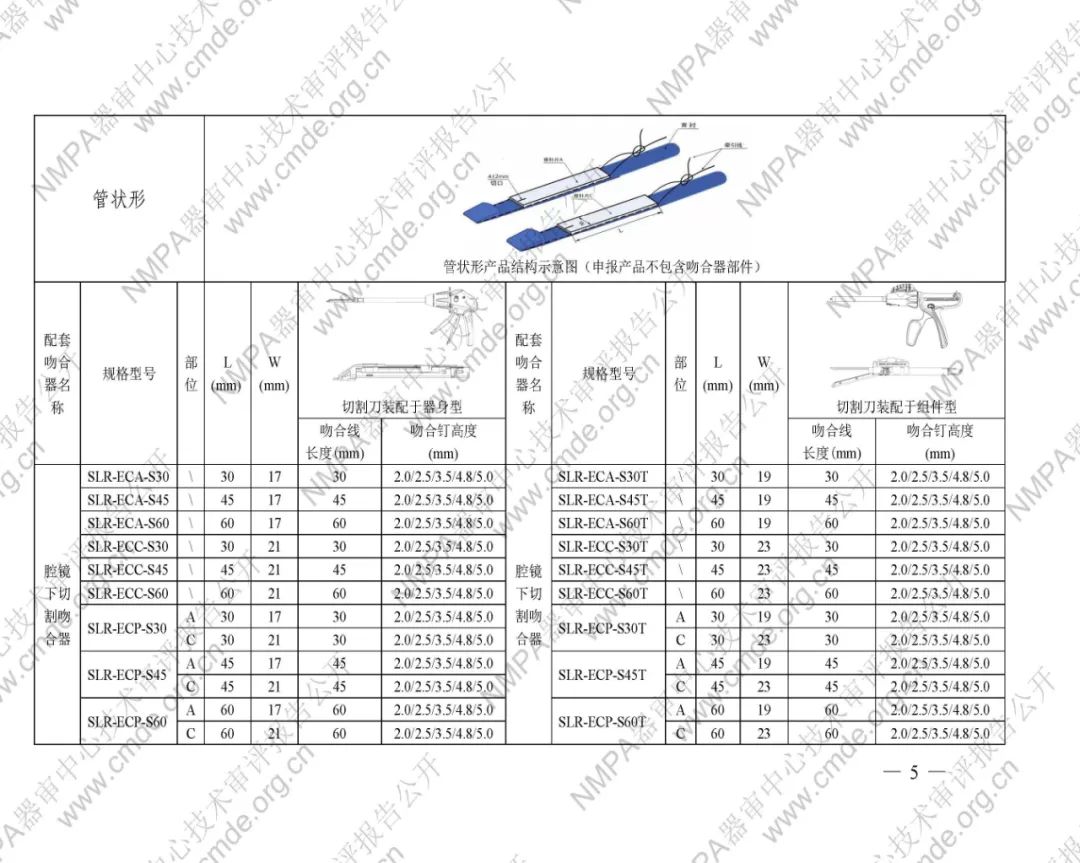
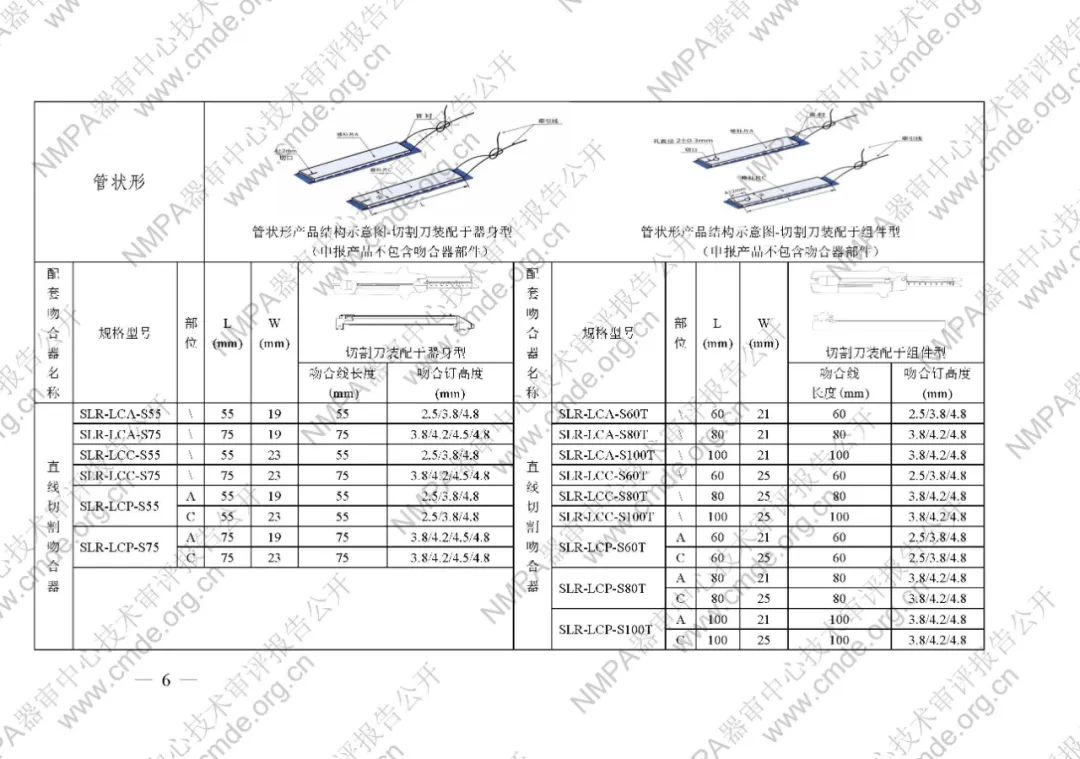
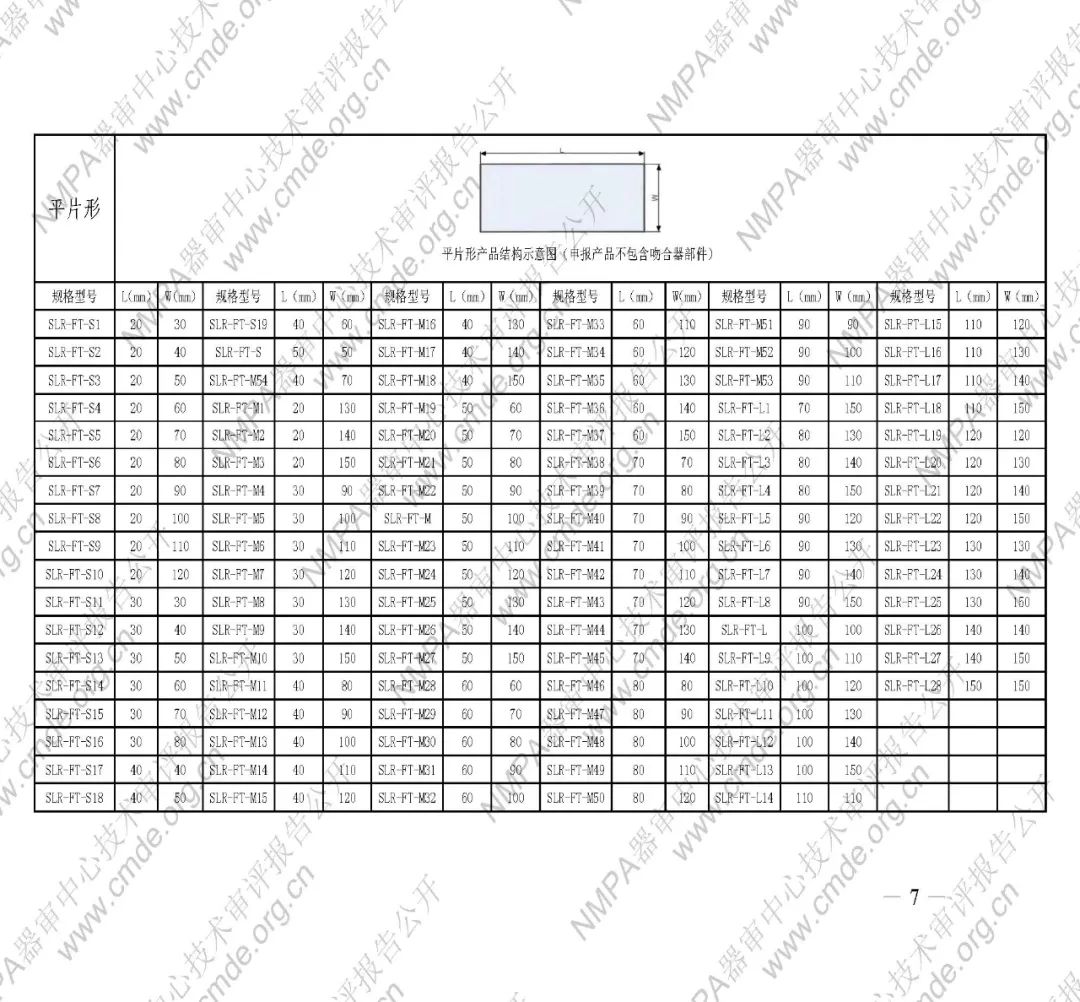
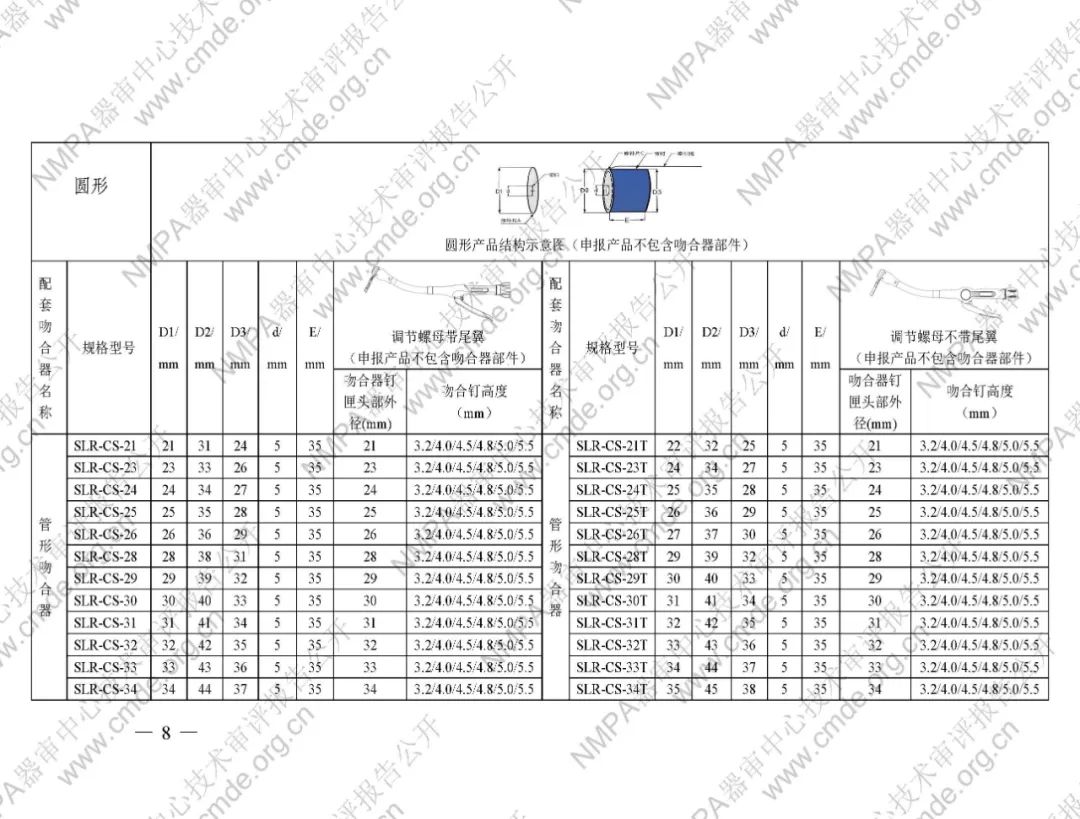
加固吻合部位,使組織斷面均勻受壓,分散釘孔處應力。
(一)產品性能研究1.產品技術要求研究產品技術要求研究項目如表2所示。
表2產品技術要求研究項目
產品性能評價包括:外觀、尺寸、厚度、縫合強度、抗張強度、頂破強度、單位面積重量、拉伸伸長率、斷裂伸長率、結構特性、可裝配性、孔隙率、酸堿度、熾灼殘渣、重金屬、環氧乙烷殘留量、過氧乙酸殘留量、豬胰蛋白酶殘留量、無菌、細菌內毒素、細胞殘留檢查、DNA殘留量、修補片吸附性能的研究、修補片降解性能的研究。
該產品修補片為植入器械,與組織持久接觸(大于30天)。申請人依據GB/T 16886系列標準進行了生物相容性評價,選擇開展的生物學試驗項目包括:熱原、細胞毒性、皮內反應試驗、遲發型超敏反應、急性全身毒性、亞慢性全身毒性、鼠傷寒沙門氏菌回復突變(Ames)試驗、體外小鼠淋巴瘤細胞突變試驗、染色體畸變試驗、植入與降解,生物相容性風險可接受。部分型號含有的背襯和牽引線,與人體組織短期接觸,申請人依據GB/T 16886系列標準進行了生物相容性評價,選擇開展的生物學試驗項目包括細胞毒性、皮內反應試驗、遲發型超敏反應。綜上,產品生物學風險可接受。
該產品為豬源性材料,申請人依據《動物源性醫療器械注冊技術審查指導原則》和YY/T 0771動物源醫療器械系列標準提供生物安全性研究資料。
申請人按照YY/T 0771動物源醫療器械系列標準,對原材料來源、收集與處置的控制進行風險管理,對病毒滅活/去除工藝進行了驗證。申請人還提供了免疫原性風險評價資料,參照GB/T 16886.20-2015《醫療器械生物學評價第20部分醫療器械免疫毒理學試驗原則和方法》對本企業相同材質的其他產品開展了免疫毒性試驗,結果表明,與陰性對照組相比,被測樣品低、中、高劑量處理28天皆未對BALB/C小鼠免疫系統的功能造成不良影響;對α-Gal抗原清除率和DNA殘留量進行檢測,作為免疫原性質量控制的項目。
生物安全性研究資料顯示產品的原料控制、病毒滅活、免疫原性和免疫毒性方面的風險可接受。
該產品采用環氧乙烷滅菌,無菌狀態提供。申請人提供了滅菌確認報告,證明無菌保證水平可達10-6。環氧乙烷殘留量不大于10μg/g,2-氯乙醇殘留量不超過5mg/cm2。
該產品貨架有效期為兩年。申請人提供了貨架有效期驗證報告,驗證方式為加速老化和實時老化驗證,包括產品穩定性、包裝完整性和運輸模擬驗證資料。
申請人開展了動物試驗研究,通過試驗用巴馬小型豬為試驗系統建立胃腸吻合動物模型,評價吻合口加固修補片在胃腸吻合口加固修補術中的安全性和有效性,觀察的指標包括臨床觀察、血液學觀察、術中療效觀察、大體解剖觀察、組織病理學觀察。研究結果表明,吻合口加固修補片90d時完全降解,使用吻合口加固修補片進行胃腸吻合,對吻合口有加固、止血的作用。供試品組與空白對照組動物的表現無明顯差異,組織病理學無可見病變。
申請人采用臨床試驗的方式進行臨床評價,臨床試驗的目的為評價申報產品用于胃部分切除吻合的軟組織的安全有效性。臨床試驗為多中心、隨機對照的優效性設計。臨床試驗在5家臨床試驗機構進行,共入組了137例受試者。試驗組為吻合口加固片配合吻合器進行手術,對照組為僅使用吻合器進行手術。主要評價指標為吻合器擊發完成切割吻合10min內需要臨床止血處置的單位長度吻合口出血點數目(觀察部位:十二指腸殘端、胃切除斷端、胃空腸吻合部位);次要有效性評價指標為吻合器擊發完成切割吻合至止血處理完畢后3min內吻合口的出血量及出血點處理時間、手術時間、吻合器操作性能參數等;安全性評價指標包括術后并發癥發生情況(吻合口出血、吻合口漏、吻合口狹窄、腹腔感染、免疫排斥反應)和不良事件發生情況。
實際入組137例受試者,其中FAS集與SS集為137例(實驗組69例,對照組68例),PPS集為128例(實驗組65例,對照組63例)。主要評價指標:吻合器擊發完成切割吻合10min內需要臨床止血處置的單位長度吻合口出血點數目FAS集實驗組為0.09±0.10個,對照組為0.16±0.14個,兩組差值95%置信區間為(-0.113,-0.030),其上限小于0;PPS集實驗組為0.08±0.09個,對照組為0.17±0.14個,兩組差值95%置信區間為(-0.130,-0.046),其上限小于0。次要評價指標吻合器擊發完成切割吻合至止血處理完畢后3min內吻合口的出血量及出血點處理時間試驗組與對照組有統計學差異(P<0.05)。不良事件發生率與嚴重不良事件發生率兩組之間無統計學意義(P>0.05)。
綜上所述,結論顯示該產品的安全性和有效性可以達到制造商的預期要求,滿足臨床需求。
(一)該產品臨床使用為適用人群帶來的主要受益為:配合吻合器用于吻合部位的加固。適用于遠端胃切除術、近端胃切除術、袖狀胃切除術、胃腸吻合術。
(二)該產品臨床使用可能為適用人群帶來的主要風險為:
本產品使用豬小腸粘膜下層組織材料,經病毒滅活、免疫原去除、成型、干燥、滅菌等工序制備而成,雖然去除了絕大部分的免疫原物質(細胞成分、動物源DNA和α-GAL抗原等),但殘留的微量免疫原物質可能會導致相應的風險。從材料安全性的角度考慮,該產品在生產過程中對所有的風險源采取了控制措施,使所有風險處于可接受準則的范圍內。
產品在某些非預期情況下,如未經過專業培訓的使用者操作、可能會因使用操作錯誤導致發生治療錯誤的風險。
(三)根據申請人提供的申報資料,經綜合評價,在目前認知水平上,認為該產品的上市為適用人群帶來的受益大于風險。但為保證用械安全,基于對主要剩余風險的規避,需在說明書中提示以下信息:
背襯和牽引線務必撤出體外廢棄,體內不要留下除修補片以外的東西,如果背襯材料被夾住時,請用剪刀等進行分離,務必將背襯和牽引線取出體外廢棄。
不可使用在需要長期才能愈合的部位。另外,不能在體內作永久性的固定作用。
作加固修補時,不要在有過度張力和負荷的部位使用,也不要在施加負荷的情況下使用。(有可能會引起破損和損傷)。
綜合評價意見
本申報產品屬于創新醫療器械(創新編號:CQTS1700209)。依據《醫療器械監督管理條例》(國務院令第739號)、《醫療器械注冊與備案管理辦法》(國家市場監督管理總局令2021年第47號)等相關醫療器械法規與配套規章,經對申請人提交的注冊申報資料進行系統評價,申報產品符合安全性、有效性的要求,符合現有認知水平,建議準予注冊。
2022年07月27日
